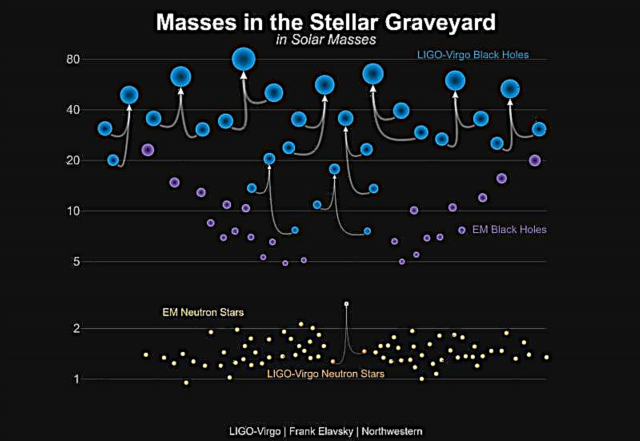
من المعروف منذ فترة طويلة أن جميع الجزيئات تمتلك شحنتين متساويتين ومتعاكستين يفصل بينهما مسافة معينة. في حالة هذه الجزيئات القطبية ، لا يتطابق مركز الشحنة السالبة مع مركز الشحنة الموجبة. يمكن وصف مدى القطبية في هذه الجزيئات التساهمية بمصطلح Dipole Moment ، وهو في الأساس مقياس القطبية في رابطة تساهمية قطبية.
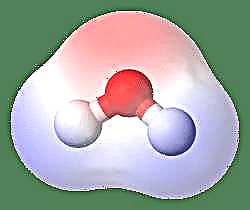
أبسط مثال على ثنائي القطب هو جزيء الماء. جزيء الماء قطبي بسبب التقاسم غير المتكافئ لإلكتروناته في هيكل "منحني". يشكل جزيء الماء زاوية ، مع ذرات الهيدروجين في الأطراف والأكسجين في الرأس. نظرًا لأن الأكسجين لديه قدرة كهرسلبية أعلى من الهيدروجين ، فإن جانب الجزيء مع ذرة الأكسجين له شحنة سالبة جزئية بينما يحتوي الهيدروجين ، في المركز ، على شحنة موجبة جزئية. وبسبب هذا ، يشير اتجاه عزم ثنائي القطب نحو الأكسجين.
في لغة الفيزياء ، فإن عزم ثنائي القطب الكهربائي هو مقياس لفصل الشحنات الكهربائية الإيجابية والسلبية في نظام الشحنات ، أي قياس القطبية الإجمالية لنظام الشحن - أي فصل الشحنة الكهربائية للجزيئات ، والتي يؤدي إلى ثنائي القطب. رياضيا ، وفي حالة بسيطة من شحنتين نقطيتين ، واحدة بشحنة + q والأخرى بشحنة؟ q ، يمكن التعبير عن عزم ثنائي القطب الكهربائي p على النحو التالي: p = qd ، حيث d هي متجه الإزاحة الذي يشير من الشحنة السالبة إلى الشحنة الموجبة. وبالتالي ، فإن نقطة ناقل العزم ثنائي القطب الكهربائي تشير من الشحنة السالبة إلى الشحنة الموجبة.
طريقة أخرى للنظر إليها هي تمثيل Dipole Moment بالحرف اليوناني m ، m = ed ، حيث e هي الشحنة الكهربائية و d هي مسافة الفصل. يتم التعبير عنها بوحدات Debye وكتابتها D (حيث 1 Debye = 1 x 10-18e.s.u cm). لحظة ثنائي القطب هي كمية متجهة ، وبالتالي يتم تمثيلها بسهم صغير مع ذيل في المركز الإيجابي والرأس يشير إلى مركز سلبي. في حالة جزيء الماء ، تكون لحظة ثنائي القطب 1.85 D ، في حين أن جزيء حمض الهيدروكلوريك هو 1.03 D ويمكن تمثيله على النحو التالي:
لقد كتبنا العديد من المقالات حول لحظة ثنائي القطب لمجلة الفضاء. في ما يلي مقال عن مصدر الماء ، وإليك مقال عن الجزيئات.
إذا كنت ترغب في الحصول على مزيد من المعلومات حول لحظة ثنائي القطب ، فراجع هذه المقالات من Hyperphysics و Science Daily.
لقد سجلنا أيضًا حلقة كاملة من علم الفلك المصبوب حول الجزيئات في الفضاء. استمع هنا ، الحلقة 116: الجزيئات في الفضاء.
مصادر:
http://en.wikipedia.org/wiki/Electric_dipole_moment
http://en.wikipedia.org/wiki/Dipole
http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/degree-polarity.php
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/dipole.html#c1
http://en.wikipedia.org/wiki/Water_molecule